Nếu bạn đang tìm giải pháp chống gỉ sét hiệu quả cho đường ống dẫn hóa chất, nguyên vật liệu xây công trình ở biển,…. thì inox 316 là giải pháp rất khả thi. Vì sao inox 316 có thể chống chịu tốt trong môi trường biển? Cùng tìm hiểu trong bài viết!
Vì sao kim loại bị gỉ sét?
Hiện tượng gỉ sét là hiện tượng sắt (hoặc hợp kim của sắt) khi để lâu ngoài trời, trải qua mưa nắng bị chuyển màu thành nâu đỏ, bị bong tróc loang lổ, lủng lỗ,… khiến cho kết cấu kim loại ngày càng yếu đi.
Ví dụ: Cánh cổng nhà trải qua mưa gió trong một năm thường bị tróc sơn, gỉ sét, lủng lỗ; cây đinh để lâu ngoài công trường bị gỉ sét, xuất hiện một lớp gỉ nâu đỏ bên ngoài; các khung thép của tòa nhà nếu để lâu dưới trời mưa cũng sẽ xuất hiện gỉ sét.

Xe tăng để lâu ngày ngoài trời bị gỉ sét
Bản chất của sự gỉ sét
Trong hóa học, gỉ sét chỉ việc kim loại bị oxy hóa, tức phản ứng với oxy tạo ra oxit kim loại. Về mặt phản ứng, gỉ sét là việc sắt bị mất đi electron. Điều kiện diễn ra gỉ sét là môi trường có cả nước và khí oxy.
Do đó, để chống gỉ sét, con người đã tìm mọi giải pháp ngăn không cho sắt tiếp xúc với nước hoặc khí oxy.
Trong môi trường biển, quá trình gỉ sét diễn ra như thế nào?
Trong môi trường biển, ngoài nước và oxy, sự xuất hiện của muối NaCl (thành phần chính) khiến cho quá trình gỉ sét diễn ra nhanh hơn rất nhiều so với trên cạn hoặc trong nước ngọt.
Ta cùng tìm hiểu nguyên nhân dưới đây.
Nước biển bao gồm những chất nào?
Trong môi trường nước biển luôn tồn tại muối NaCl. Tuy nhiên, trên thực tế NaCl sẽ không tồn tại dưới dạng phân tử NaCl nguyên bản, mà lại tồn tại dưới dạng ion Na+ và Cl-. Ngoài ra, còn có thêm nhiều ion khác như: Mg2+, SO42-; Ca2+; K+;…
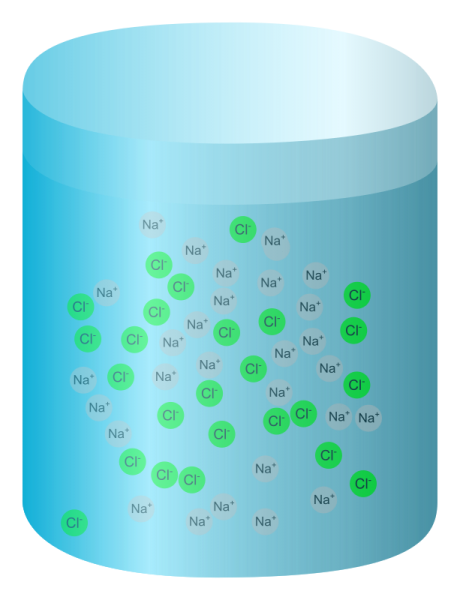
Các ion tồn tại trong dung dịch nước muối
Muối trong nước sẽ tồn tại như thế nào?
Dưới góc nhìn hóa học, muối nguyên chất có dạng rắn, màu trắng, là NaCl. Khi được pha vào nước, muối sẽ hòa tan. Lúc này ta được dung dịch nước muối. Dung dịch nước muối gồm một chuỗi các phân tử nước H2O bao lấy các ion Na+ và Cl-.
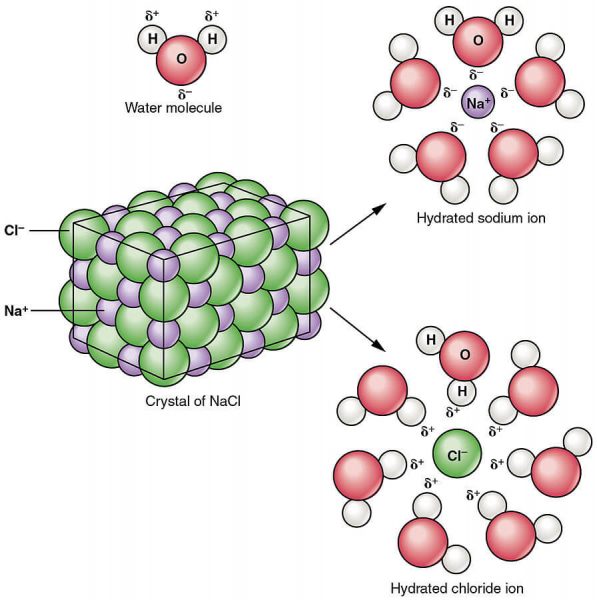
Muối NaCl bị phân tách khi hòa tan vào nước
Vậy dung dịch ion Na+, Cl- ảnh hưởng thế nào đến quá trình gỉ sét?
Dung dịch nước muối đã vô tình cung cấp các ion giúp quá trình gỉ sét diễn ra nhanh hơn.
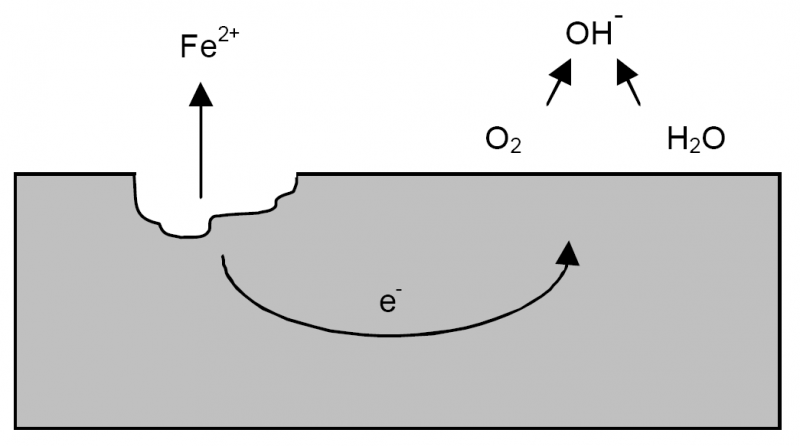
Minh họa việc di chuyển mất electron và sự di chuyển electron trong sắt
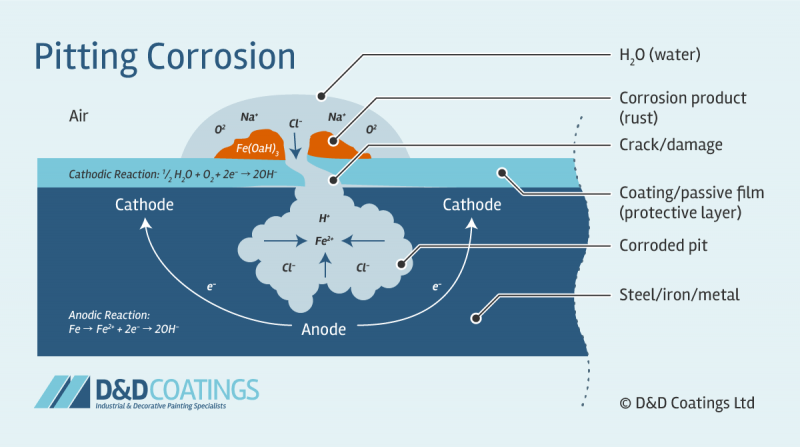
Minh họa quá trình gỉ sét của sắt dẫn đến ăn mòn lỗ
Nguồn: D & D Coatings
Quá trình gỉ sét diễn ra như sau:
- Đầu tiên, lớp bảo vệ kim loại sẽ bị phá hủy, để lộ ra sắt bên trong.
- Sau đó, Fe có xu hướng mất đi electron: Fe -> Fe2+ + 2e- để chuyển thành ion Fe2+.
- Các electron sau khi tách ra từ Fe sẽ di chuyển (trong lớp kim loại) lên bề mặt bên ngoài (vốn tập hợp nhiều ion Na+ dương).
- Ion Fe2+ sẽ di chuyển tách ra khỏi lớp kim loại, hòa tan vào trong nước.
- Lúc này khu vực diễn ra quá trình gỉ sét sẽ giống như một cục pin thu nhỏ (ảnh trên), với cực âm (anode) nằm ở đáy của lỗ ăn mòn và cực dương (cathode) sẽ nằm ở bề mặt kim loại, vị trí hai bên lỗ ăn mòn.
Sự xuất hiện của ion Fe2+ sẽ thu hút các ion âm Cl- di chuyển và và hình thành nên một chuỗi các phản ứng khác tạo nên sắt clorua và sắt (II) hidroxit. Cụ thể như sau:
- Fe2+ + Cl− → [FeCl complex]+ (phản ứng số 1)
- [FeCl complex]+ + 2 H2O → Fe(OH)2 + 2 H+ + Cl− (phản ứng số 2)
Việc hình thành Fe(OH)2 kết hợp việc xuất hiện ion H+ tạo tiền đề cho việc hình thành Fe3+ và gỉ sét (Fe2O3) khi Fe(OH)2 di chuyển và gặp oxy ở bên ngoài:
- Trường hợp chỉ có oxy: 4Fe(OH)2 + O2 + xH2O → 2Fe2O3.(x+4)H2O (phản ứng số 3)
- Trường hợp có cả ion H+ lẫn oxy: 4Fe2++ 4H+ + O2 -> 4Fe3+ +2H2O (phản ứng số 4)
Trong phản ứng trên, Fe3+ là tiền đề tạo nên gỉ sét (Fe2O3)
Vậy sự gỉ sét diễn ra như thế nào trong môi trường kiềm và axit?
Trong môi trường nước, người ta sử dụng độ pH để biết được đó là môi trường kiềm, trung tính hay axit.
Với pH = 7, môi trường trung tính. Lúc này nồng độ ion H+ và OH- tương đương nhau.
Với pH < 7, đây là môi trường axit. Lúc này nồng độ H+ cao hơn OH-. Tức số lượng ion H+ nhiều hơn ion OH-. Trong môi trường axit, với nồng độ H+ cao, phản ứng số 4 (Fe2+ -> Fe3+) diễn ra nhanh, tạo tiền đề hình thành gỉ sét nhanh hơn.
Vơi pH > 7, đây là môi trường kiềm. Mọi chuyện là ngược lại. Lúc này nồng độ và số lượng ion OH- cao hơn nồng độ và ion H+. Trong môi trường kiềm, phản ứng số 2 diễn ra nhanh hơn, tạo ra thêm nhiều ion H+, thúc đẩy phản ứng số 4 diễn ra nhanh từ đó gỉ sét nhanh hình thành hơn.
Vì sao inox 316 có thể chống chịu tốt trong môi trường biển, axit tốt hơn inox 304?
Trước khi đi tìm nguyên nhân, ta cùng xem lại thành phần của 2 mác thép 304 và 316:
| Số hiệu UNS | S30400 | S31600 |
| Carbon (C) | ≤ 0.08% | ≤ 0.08% |
| Mangan (Mn) | ≤ 2.00% | ≤ 2.00% |
| Photpho (P) | ≤ 0.045% | ≤ 0.045% |
| Lưu huỳnh (S) | ≤ 0.03% | ≤ 0.03% |
| Silic (Si) | ≤ 1.00% | ≤ 1.00% |
| Crom (Cr) | 18.0 – 20.0% | 16.0 – 18.0% |
| Nickel (Ni) | 8.0 – 11.0% | 11.0 – 14.0% |
| Molybdenum (Mo) | 2.00 – 3.00% |
Như ta đã thấy ở bảng trên, sự khác nhau cơ bản của inox 316 so với inox 304 như sau:
- Hàm lượng Crom giảm 2%
- Hàm lượng Niken tăng 3%
- Thêm tối thiểu 2% Molybdenum
Và nhân tố chính là Molybdenum (gọi tắt là Mo). Mo hỗ trợ tăng cường cho lớp oxit bên ngoài chống lại tác động của môi trường nước biển (môi trường clorit).
Đây là bảng nghiên cứu của một nhóm nghiên cứu trong phòng thí nghiệm:
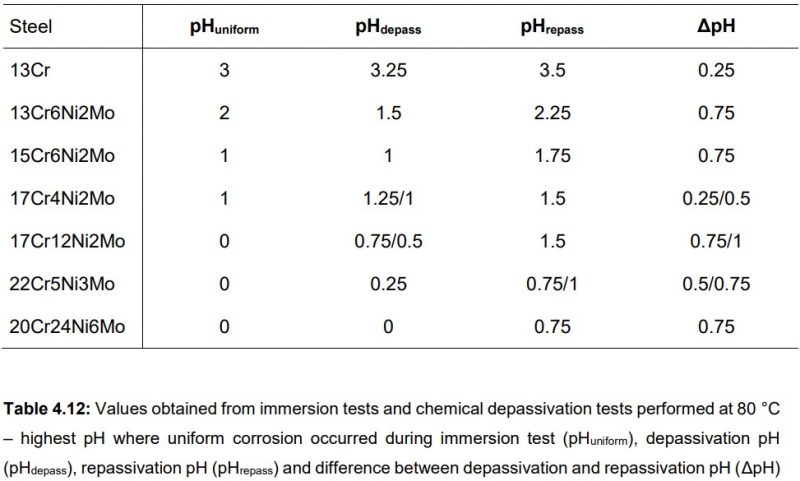
Bảng giá trị pH ở ngưỡng bắt đầu bị ăn mòn (depassivation) và (tái kích hoạt lớp oxit chống chịu bị động) repassivation của các loại thép không gỉ. Inox với 17Cr12Ni2Mo chính là mác thép 316
Nguồn: https://pure.unileoben.ac.at/
Với bảng trên, có thể thấy hàm lượng crom, niken & molybdenum trong inox tỉ lệ nghịch với độ pH, tỉ lệ thuận với độ chống chịu trong môi trường axit (bao gồm axit HCl và 5% nước muối NaCl).
Do đó, trong môi trường biển, việc sử dụng biển inox 316 (với công thức 17Cr12.5Ni2.5Mo sẽ chống chịu tốt, bền bỉ hơn inox 314 (18Cr9.5Ni).
Còn đối với inox 304?
So với inox 316, inox 304 có hàm lượng niken ít hơn 2% và đặc biệt là không có molybdenum, thành phần chính giúp inox 316 chống lại sự ăn mòn trong môi trường axit. Do đó, trong môi trường axit, lớp bảo vệ crom oxit Cr2O3 sẽ bị mài mòn, làm lộ ra lớp sắt bên trong, dẫn đến quá trình gỉ sét.
Độ pH càng thấp, ion H+ càng nhiều, khả năng bào mòn càng cao. Tùy vào hàm lượng crom và niken mà loại inox 304 sẽ có giới chịu đựng nhất định. Vượt quá giới hạn đó, quá trình gỉ sét sẽ diễn ra.

Tác dụng của molybdenum trong thép không gỉ?

Khối molybdenum
Mo có tác dụng tăng cường sức chống chịu cho lớp oxit bằng cách giúp hình thành một lớp crom oxit Cr2O3 và molybdenum oxit với Mo4+ (MoO2). Molybdenum trong thành phần giúp làm tăng khả năng tái tạo lại lớp oxit bảo vệ trong trường hợp lớp cũ đã bị bào mòn mất.
Ngoài ra, Mo còn tham gia vào quá trình tạo ra các ion âm MoO42-giúp tạo thêm một lớp bên ngoài, ngăn chặn các ion Cl- tiếp xúc với lớp Cr2O3 bên trong. Nghĩa là nhờ có Mo mà thép không gỉ chống chịu tốt hơn trong môi trường axit.
Và một số nghiên cứu còn chỉ ra rằng sự hiệu quả của Mo là nhờ có Crom và Nitơ trong hợp chất.
Vậy niken có đóng vai gì trong việc chống chịu sự gỉ sét hay không?
Với việc thêm vào molybdenum, hàm lượng niken cũng được tăng lên vừa để duy trì được cấu trúc austenite vừa làm tăng khả năng chống chịu cho inox 316 (thêm quá molybdenum nhiều vào hợp kim vừa tốn chi phí vừa có thể thay đổi cấu trúc tinh thể của loại thép không gỉ ấy).
Trong hợp kim, niken giúp làm giảm cường độ dòng điện (dòng electron) di chuyển, từ đó gián tiếp làm chậm quá trình gỉ sét, giúp lớp oxit bảo vệ có thời gian tái tạo trong trường hợp đã bị bào mòn.
Do đó, việc tăng thành phần niken giúp cho thép không gỉ chống lại ăn mòn lỗ (pitting corrosion), ăn mòn khe nứt (crevice corrosion) tốt hơn trong môi trường axit và môi trường biển.
Đối với thép không gỉ, môi trường biển là một môi trường khắc nghiệt. Do đó, nhiều mác thép không gỉ vẫn bị gỉ trong nước biển.
Để chống chịu ăn mòn tốt, thép không gỉ cần có molybdenum trong thành phần. Vì thế, inox 316 sẽ chống chịu tốt hơn inox 304.
Nếu doanh nghiệp của quý khách đang tìm kiếm đơn vị cung cấp các loại ống inox công nghiệp 304, 316, tấm, phụ kiện ống inox mác thép 304 cũng như mác thép 316 là cho công trình của mình, vui lòng liên hệ QMS – Inox Quang Minh qua số Hotline/Zalo: 0906.345.304 để được tư vấn và báo giá ngay!